中國科學院蘇州生物醫學工程技術研究所展示的雙光子顯微鏡。
武漢友芝生物制藥有限公司科研人員在進行實驗。
本報記者 杜 芳攝
“腫瘤高發,為什麼沒有我們自己的藥物?”“外國藥太貴了,可便宜的國產藥能達到治療效果嗎?”“這些藥安全嗎?”這些醫生們常常聽到的問題,最能反映百姓心中存在已久的顧慮,創新、有效、安全成為擺在中國醫藥研制面前的三道考題。
如今,隨著重大新藥創制國家科技重大專項的實施推進,新藥創制格局發生改變,一批藥物創制關鍵技術和生產工藝得以突破,我國自主研發的創新藥物登臺亮相,不但在一些領域打破了國外專利藥物壟斷,而且藥品安全性、可靠性提升。醫藥研發正由倣制逐漸走向創制,我國正從一個醫藥大國向醫藥強國邁進。
新藥研發能力大幅提升
一批藥物創制核心關鍵技術取得突破,藥品質量明顯提升,我國新藥創新能力得到國際認可
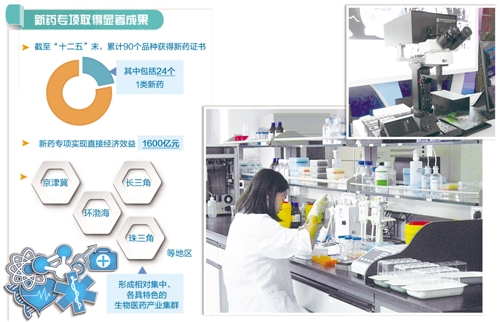
重大新藥創制國家科技重大專項實施8年來,碩果累累。新藥專項實施管理辦公室主任、國家衛生計生委科教司司長秦懷金告訴《經濟日報》記者,截至“十二五”末,累計90個品種獲得新藥證書,其中包括手足口病EV71型疫苗、Sabin株脊灰滅活疫苗、西達本胺、阿帕替尼等24個1類新藥,是專項實施前總和的5倍。
與此同時,一批核心關鍵技術取得了突破。秦懷金介紹,我國突破了抗體和蛋白藥物制備、生物大分子藥物給藥、藥物緩控釋制劑、中成藥二次開發等一批瓶頸性關鍵技術,臨床前評價、疫苗研發等技術逐步實現“跟跑”向“並跑”的轉變。
新藥的不斷推出,讓中國的老百姓實實在在受益。我國在肺癌、白血病、耐藥菌防治等領域打破國外專利藥物壟斷後,面對昂貴的外國藥便有了議價權。“國產小分子靶向抗癌藥鹽酸埃克替尼上市促使國外專利藥物降價超過50%,大幅減輕患者用藥負擔。”秦懷金說,不僅如此,我國技術改造200余種臨床急需品種,涉及15.3%的國家基本藥物,藥品質量明顯提升,滿足了國內百姓的需求。
自從我國科學家屠呦呦獲得諾貝爾獎,青蒿素的名字走進了大眾視野,這種神奇的中藥對于瘧疾有明顯療效。而現在,中國科學家又提取出青蒿素的延伸物青蒿琥酯,它具有更強的作用和更長久的療效。青蒿琥酯通過世界衛生組織認證,在國外使用,累計救治1500萬瘧疾患者。中國新藥不僅填補國內空白,也走向世界,為人類健康作出了突出貢獻。
中國藥,再也不是“低端藥”的代名詞。我國新藥研發創新能力得到國際認可,拉莫三嗪獲得美國FDA批準上市,利培酮微球注射劑獲得美國FDA批準,直接提交新藥申請,地奧心血康、丹參膠囊等獲得歐盟上市許可。帕拉米韋、磷酸奧司他韋、埃博拉病毒治療性抗體MIL77、重組埃博拉病毒疫苗等應急藥品,為應對全球應急事件——傳染病的流行提供重要的生物安全保障。
技術創新能力不斷提升也使得我國醫藥產業快速發展。據初步統計,新藥專項實現直接經濟效益1600億元,推動企業創新主體地位持續增強,2015年規模以上企業研發投入約450億元;促進京津冀、環渤海、長三角、珠三角等地區形成相對集中、各具特色的生物醫藥產業集群,加快了區域經濟發展和產業轉型升級。
安全評價與國際接軌
我國藥物非臨床安全性評價平臺法規依從性進一步提高,國內新藥加快進入國際主流市場的步伐
“新藥研發涉及各個學科,環節多、周期長、創新活動復雜,從靶標確定到產品開發上市的全鏈條研發過程中,藥物非臨床安全評價(GLP)是新藥研發必要階段中極其重要的一環。”新藥專項技術總師、中國工程院院士桑國衛說。
在新藥專項支持下,我國藥物非臨床安全性評價平臺(GLP)建設取得了一係列重大突破,GLP平臺的法規依從性進一步提高,平臺管理水平獲得國際認可,新藥臨床前安全評價工作已與國際接軌。
桑國衛介紹,我國已有11個平臺通過了國際實驗動物評估和認可委員會(AAALAC)認證,4個平臺接受並通過了美國FDA的GLP檢查,5個平臺通過了經濟合作與發展組織(OECD)成員國正式GLP檢查,3個平臺通過美國病理學家協會(CAP)認證,9個平臺按照國際標準建立了實驗室數據採集與管理的IS/IT係統、Provantis GLP Tox軟件和LIMS係統。
這些平臺瞄準國際新技術方法發展前沿,進一步完善藥物非臨床安全性評價技術體係,核心關鍵技術達到國際先進水平。桑國衛說,GLP平臺為國內外藥物研發企業提供規范的技術服務,累計開展3500余個藥物的非臨床安全性評價研究,為我國具有自主知識產權的創新藥物研發提供了重要保障。此外,8個GLP平臺幫助我國醫藥企業提交境外新藥臨床研究申請300余個,推動一批國內研發的藥品在美國、歐盟等地開展臨床試驗,大大加快了國內新藥進入國際主流市場的步伐。
同時,在新藥專項的帶動下,我國已有63家GLP實驗室通過了國家食品藥品監督管理局認證,這些蓬勃發展的GLP實驗室在我國新藥研發產業鏈中發揮著越來越重要的作用。部分GLP平臺除了開展藥品的安全性評價研究外,還將GLP平臺技術拓展到了農藥、動物食品、獸藥和環境毒物等領域的安全性研究,帶動和促進了其他行業的規范發展。
桑國衛表示,“十三五”期間,新藥專項將繼續圍繞“出新藥”“保安全”的戰略需求,針對當前國內藥物毒理學研究的薄弱環節,進一步全面提升我國GLP平臺的創新能力和國際競爭力,使其充分發揮對新藥研發創新鏈的“引領式”服務。
抓住一致性評價的關鍵
我國要更嚴格地做好一致性評價工作,確保倣制藥在質量和療效上與原研藥保持一致
根據創新程度,藥品可分為兩個層級:創新藥和倣制藥。我國是個倣制藥大國,卻不是倣制藥強國,低水平倣制扎堆現象嚴重,部分倣制藥存在質量不高、療效較弱等問題。
安全用藥、滿足臨床需求是新藥專項的目標,我國要向創新藥物和倣制藥物多投入,尤其需要通過嚴格的一致性評價獲得高質量的倣制藥。
2015年,一致性評價工作開展,相關政策文件密集發布。中國食品藥品檢定研究院院長李波表示,“一致性評價工作是大家關注的熱點,一致性評價的目的就是要使國內上市的倣制藥在質量和療效上與原研藥保持一致,在臨床上與原研藥可以相互替代,滿足公眾對高質量倣制藥的需求;同時降低藥品費用的總支出,淘汰落後產能,提高國產倣制藥在國際上的競爭力”。
一致性評價“大考”開啟,加快了我國醫藥產業優勝劣汰、轉型升級的步伐。目前,已經通過新版GLP認證的國內5000多家制藥企業,除了研發實力比較強的大企業以外,大部分企業都需要平臺支撐。
重大專項支撐的平臺優勢得以充分發揮,其利用技術儲備對一致性評價工作進行技術支撐,一方面為新藥和倣制藥一致性評價工作需要的關鍵技術、出現的問題保駕護航,另一方面在國內重大科研院所和專項支持的平臺以及企業間搭建橋梁,加快推進一致性評價工作。
“此外,臨床前安全評價平臺不但承擔著國家創新藥物的安全性評價的重要職責,同時也承擔著由于藥物引起的或者可能引起的毒性作用及其毒性機制進行深入研究的重要職責。”中科院上海藥物研究所藥物安全評價研究中心主任任進說。
今年,牽動千家藥企神經的倣制藥一致性評價將進入全面監督評價階段。石藥、華潤雙鶴、羅欣藥業等諸多藥企都紛紛表示,正在加速推進倣制藥質量和療效一致性評價進程。
“新藥專項也罷,生物醫藥產業也罷,正在經歷以倣制為主到創倣結合的過程。”桑國衛說,“創新藥的關鍵在于創新,包括新的靶點、新的結構、新的作用機制,也包括疾病譜的改變所導致的藥物研究的創新。倣制藥研發的關鍵是,要嚴格做好一致性評價工作,任務雖然艱巨,但我們有信心”。(經濟日報·中國經濟網記者 杜 芳)
[責任編輯:郭曉康]