據國家食品藥品監督管理總局官網近日消息,為加強醫療器械質量監督管理,保障醫療器械產品使用安全有效,國家食品藥品監督管理總局組織對一次性使用輸液器重力輸液式(帶針)、中醫診療電氣設備、連續性血液凈化設備等6個品種463批(臺)的產品進行了質量監督抽驗。現將抽驗結果公告如下:
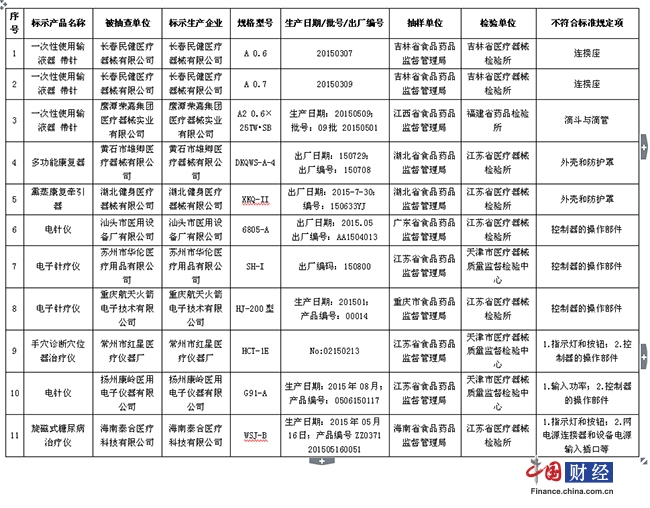
一、被抽驗項目不符合標準規定的醫療器械產品,涉及10家醫療器械生產企業的2個品種11批(臺)。具體為:
(一)一次性使用輸液器重力輸液式(帶針)2家企業3批產品。長春民健醫療器械有限公司生產的2批次一次性使用輸液器(帶針),連接座不符合標準規定;鷹潭榮嘉集團醫療器械實業有限公司生產的1批次一次性使用輸液器(帶針),滴鬥與滴管不符合標準規定。
(二)中醫診療電氣設備8家企業8臺產品。黃石市雄卿醫療器械有限公司生產的1臺多功能康復器、湖北健身醫療器械有限公司生產的1臺熏蒸康復牽引器,外殼和防護罩不符合標準規定;汕頭市醫用設備廠有限公司生產的1臺電針儀,蘇州市華倫醫療用品有限公司、重慶航天火箭電子技術有限公司生產的各1臺電子針療儀,控制器的操作部件不符合標準規定;常州市紅星醫療儀器廠生產的1臺手穴診斷穴位器治療儀,指示燈和按鈕、控制器的操作部件不符合標準規定;揚州康嶺醫用電子儀器有限公司生產的1臺電針儀,輸入功率、控制器的操作部件不符合標準規定;海南泰合醫療科技有限公司生產的1臺旋磁式糖尿病治療儀,指示燈和按鈕、網電源連接器和設備電源輸入插口等不符合標準規定。
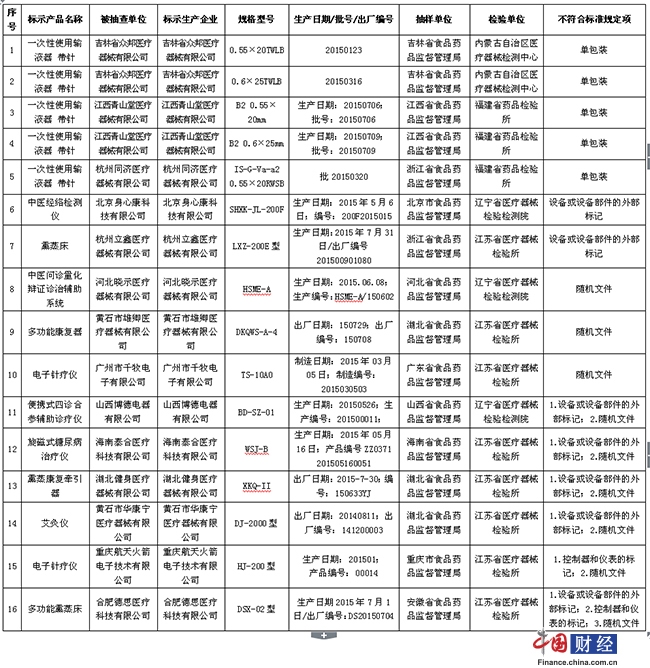
二、被抽驗項目為標識標簽、說明書等項目不符合標準規定的醫療器械產品,涉及14家醫療器械生產企業的2個品種16批(臺),具體為:
(一)一次性使用輸液器重力輸液式(帶針)3家企業5批產品。吉林省眾邦醫療器械有限公司生產的2批次、江西青山堂醫療器械有限公司生產的2批次、杭州同濟醫療器械有限公司生產的1批次一次性使用輸液器(帶針),單包裝不符合標準規定。
(二)中醫診療電氣設備11家企業11臺產品。北京身心康科技有限公司生產的1臺中醫經絡檢測儀、杭州立鑫醫療器械有限公司生產的1臺熏蒸床,設備或設備部件的外部標記不符合標準規定;河北曉示醫療器械有限公司生產的1臺中醫問診量化辯證診治輔助係統、黃石市雄卿醫療器械有限公司生產的1臺多功能康復器、廣州市千牧電子有限公司生產的1臺電子針療儀,隨機文件不符合標準規定;山西博德電器有限公司生產的1臺便攜式四診合參輔助診療儀、海南泰合醫療科技有限公司生產的1臺旋磁式糖尿病治療儀、湖北健身醫療器械有限公司生產的1臺熏蒸康復牽引器、黃石市華康寧醫療器械有限公司生產的1臺艾灸儀,設備或設備部件的外部標記、隨機文件不符合標準規定;重慶航天火箭電子技術有限公司生產的1臺電子針療儀,控制器和儀表的標記、隨機文件不符合標準規定;合肥德思醫療科技有限公司生產的1臺多功能熏蒸床,設備或設備部件的外部標記、控制器和儀表的標記、隨機文件不符合標準規定。
三、抽驗項目全部符合標準規定的醫療器械產品涉及203家醫療器械生產企業的6個品種440批(臺)。
四、對上述抽驗中發現的不符合標準規定的產品,國家食品藥品監督管理總局已要求企業所在地食品藥品監督管理部門按照《醫療器械監督管理條例》及《食品藥品監管總局辦公廳關于進一步加強醫療器械抽驗工作的通知》(食藥監辦械監〔2016〕9號),對相關企業進行調查處理。
相關醫療器械生產企業應對不符合標準規定產品、不符合標準規定項目進行風險評估,根據醫療器械缺陷的嚴重程度確定召回級別,由企業主動召回並公開召回信息。企業所在地食品藥品監督管理部門要對企業召回情況進行監督,未組織召回的應責令召回;如發現不符合標準規定醫療器械產品對人體造成傷害或者有證據證明可能危害人體健康的,可以採取暫停生產、進口、經營、使用的緊急控制措施。
相關省級食品藥品監督管理部門要督促企業盡快查明原因,制定整改措施並按期整改到位,有關處置情況于2016年8月30日前向社會公布。
[責任編輯:李帥]